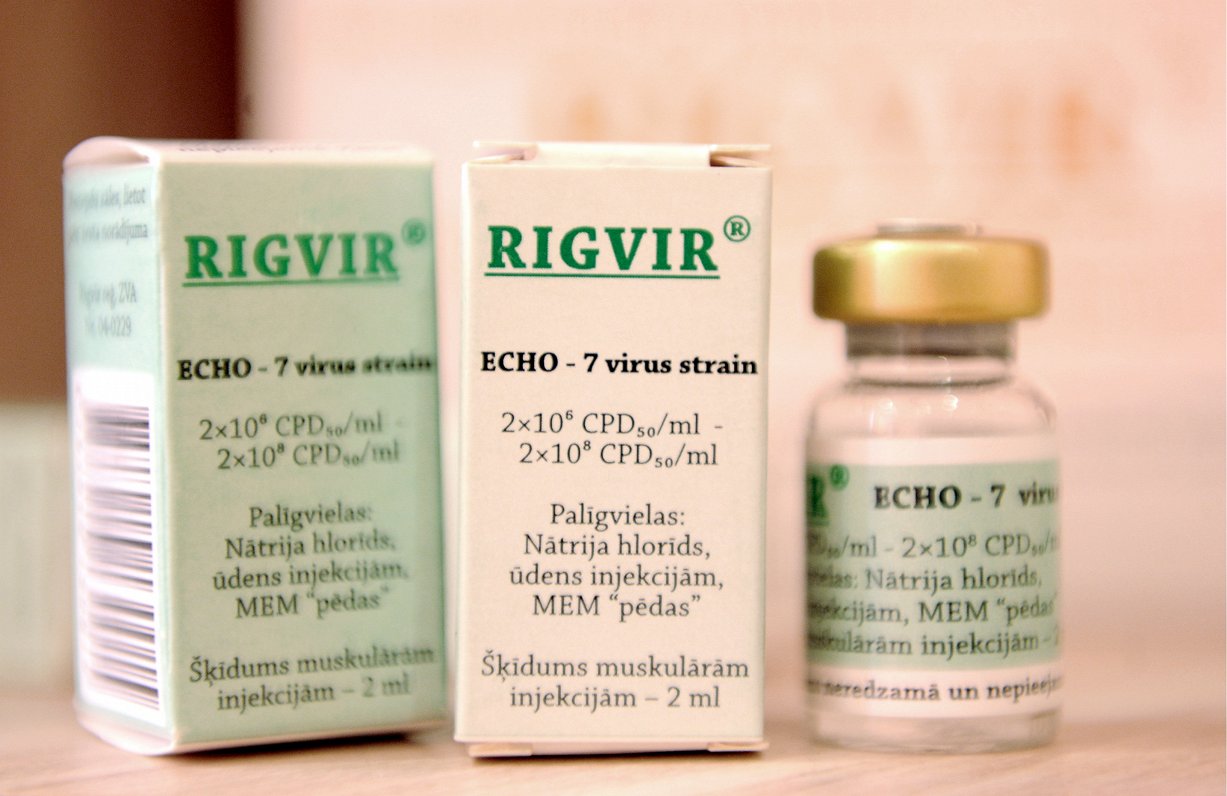
Aptur reģistrāciju
Zāļu valsts aģentūrā informēja, ka šā gada laikā tika konstatēti kvalitātes defekti vairākām “Rigvir” sērijām, tādēļ tika apturēta šo zāļu izplatīšana. Uzņēmums SIA “Latima”, kas zāles “Rigvir” ir reģistrējis, joprojām nav noteicis konkrētu, viennozīmīgu neatbilstības cēloni konstatētajam kvalitātes defektam.
Uzņēmums arī šo zāļu pēcreģistrācijas periodā nav izpildījis normatīvos aktos noteiktos pienākumus un aktualizējis zāļu reģistrācijas dokumentāciju, tādēļ Zāļu valsts aģentūra ir apturējusi šo zāļu reģistrācijas apliecības darbību līdz neatbilstību novēršanai.
Šobrīd uzņēmumam ir noteikti vairāki pienākumi, lai atjaunotu zāļu reģistrāciju.
Ļauj izplatīt vienu zāļu sēriju
Vienlaikus Veselības inspekcija atļāvusi izplatīt vienu “Rigvir” sēriju tikai tiem melanomas pacientiem, kuriem ārstēšana jau ir uzsākta. Šī “Rigvir” sērija (Nr. B0119R) ir ražota 2019. gada janvārī un pēc testēšanas rezultātiem atbilst kvalitātes prasībām, taču kvalitātes pārbaude veikta ar metodi, kas nav atbilstoši izvērtēta un apstiprināta. Līdz ar to ir pieņemts lēmums, ka šīs zāļu sērijas “Rigvir” lietošana ir atļauta, ārstam un pacientam uzņemoties pilnu atbildību par izvēli turpināt ārstēšanu ar šīm zālēm.
Zāļu apmaksa caur valsts zāļu kompensācijas sistēmu “Rigvir” netiek piemērota.
Inspekcija norāda, ka Zāļu izplatīšanas un kvalitātes kontroles noteikumi paredz ārkārtas apstākļos izņēmuma gadījumā atļaut piegādāt zāles pacientiem, kas ar tām jau tiek ārstēti. Ar aicinājumu atcelt aizliegumu izplatīt recepšu zāles “Rigvir” vērsās 38 pacienti. Tāpat atļaut “Rigvir” sērijas izplatīšanas izņēmumu atbilstoši normatīvajos aktos paredzētajam ir aicinājušas piecas ārstniecības iestādes un 16 onkologi, ģimenes ārsti, onkologs-ķīmijterapeits, imunologs un dermatologs.
Nedrīkst jauniem pacientiem
“Rigvir” sēriju, ko izņēmuma gadījumā ir atļauts izplatīt, drīkst lietot tikai tie pacienti, kuriem ārstēšana ar “Rigvir” jau ir uzsākta.
Ārstēšanu ar šīm zālēm nedrīkst uzsākt jauniem pacientiem.
Līdzšinējo pacientu ārstēšanai minēto zāļu sēriju drīkst lietot tikai pēc tam, kad ārsts ir stingri izvērtējis šo zāļu lietošanas guvumu un risku katram pacientam individuāli. Pirms “Rigvir” parakstīšanas pacients jāiepazīstina ar informētās piekrišanas dokumentu un tajā ietverto brīdinājumu. Ārstam un pacientam ir obligāti jāparaksta informētās piekrišanas dokuments, apliecinot, ka viņi ir iepazinušies ar riskiem, kas saistīti ar zāļu lietošanu, kuras nav testētas ar reģistrācijas dokumentācijā apstiprināto metodi.
Pacientam ir tiesības atteikties no terapijas ar “Rigvir”, ņemot vērā šajās zālēs konstatēto kvalitātes neatbilstību. Tādējādi lēmumu par ārstēšanu pieņem pacients kopā ar ārstniecības personu.
Cik vien iespējams drīz, ārstam jāpārvērtē līdzšinējo pacientu ārstēšana un “Rigvir” jānomaina pret atbilstošu cita veida terapiju. Ārsti šajā ziņā sniegto informāciju par “Rigvir” saņems speciālā vēstulē veselības aprūpes speciālistiem.
KONTEKSTS:
Saistībā ar konstatētām nepilnībām Zāļu valsts aģentūra (ZVA) pieņēmusi lēmumu apturēt "Rigvir" izplatīšanu līdz neatbilstības cēloņa noskaidrošanai un novēršanai. Turklāt Nacionālais veselības dienests pieņēmis lēmumu par "Rigvir" svītrošanu no valsts Kompensējamo zāļu saraksta.
Lēmums saistīts ar to, ka ZVA saņemtie Lielbritānijas oficiālās zāļu kvalitātes kontroles laboratorijas rezultāti liecina - "Rigvir" sastāvā ir mazāks vīrusa daudzums, nekā apstiprināts, šīs zāles reģistrējot. Bet vēlāk atklājies, ka, apstrīdot "Rigvir" izplatīšanas aizliegumu, iesniegti ar nereģistrētu metodi iegūti testa rezultātus.